伦理审查申请指南
2021-09-18
伦理审查申请指南
请仔细阅读以下简介:
1.向本伦理委员会提交资料前,需先经药物临床试验机构审核通过后,再按照以下递交指南的内容准备递交资料;
2.我院作为参加研究单位,需等获得组长单位伦理批件后,再递交伦理委员会;若组长单位≥2家,须获得所有组长单位批件后再递交伦理委员会。
3.根据伦理审查申请/报告的类别,填写相应的“申请” (初始审查申请,修正案审查申请,复审申请),或“报告”(年度/定期跟踪审查报告,SUASR/安全性信息报告,方案偏离报告,暂停/终止研究报告,结题报告);
4.首先提交1套送审文件(可通过伦理系统),通过形式审查后,下载伦理系统中通过形式审查的资料(水印+二维码版),准备书面送审材料纸质版,送至伦理委员会办公室;
5. 本指南中所有打“※”的文件均需使用本伦理委员会模板,可在本医院网站下载(网址:http://www.myzxyy.com/departments_wyh_lcsyluwy/2021/NbW7Jnby.html)或者CRX QQ群——伦理相关文件夹下载;
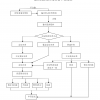
一、初始审查
1. 药物临床试验完整版资料(3份,蓝色2孔文件夹按以下顺序整理,其中证明性文件需申办者公章)
1) 临床试验初审审查申请表※(含PI声明和COI;PI签名并注明日期)
2) 国家药品监督管理局《药物临床试验批件》或《临床试验通知书》或《备案信息文件》
3) 临床试验方案(注明版本号、版本日期,本中心PI签字、申办方、CRO (如有)盖章)
4) 知情同意书(注明版本号和日期)
5) 病例报告表(CRF)(注明版本号和日期,可刻录光盘)
6) 研究者手册(IB)(注明版本号和日期)
7) 研究病历(如有)(注明版本号和日期)
8) 药物说明书(如有)
9) 招募广告及招募方式说明(如有)(注明版本号和日期)
10) 试验保险(如有)(提供保险凭证,如是外文凭证,需提供中文翻译版本,并提供两个版本一致性说明,公司盖章)
11) CRO的资质证明(如有)(营业执照,药品/器械生产许可证等)
12) 申办方和CRO之间的委托书或合同(如有)
13) 组长单位的批件、其他伦理委员会对本项目的否定性意见(如有)
14) 研究者简历(签名和日期,GCP证书复印件) ※
15) 研究团队名单
16) 数据安全监察计划(Data Safbty Monitor Plan, DSMP)(如有)(注明版本号、版本日期;如方案中有可不必单列)
17) 风险控制计划(如有)(如方案中有可不必单列)
18) 其他提供给受试者的文件(含版本号、版本日期),例如调査问卷、受试者日记卡等(如有请具体化)
19) 临床试验合同
20) 药物临床试验机构临床试验申请表(已同意立项)
21) 安全性审查报告或SUSAR列表(如有)
2. 医疗器械临床试验完整版资料(3份,蓝色2孔文件夹按以下顺序整理,其中证明性文件需申办者公章)
1)临床试验初审审查申请表※(含PI声明和COI;PI签名并注明日期)
2)国家药品监督管理局《临床试验批件》或《临床试验通知书》或《备案信息文件》
3)试验方案(注明版本号、版本日期,本中心PI签字、申办方、CRO (如有)盖章)
4)知情同意书(注明版本号和日期)
5)病例报告表(CRF)(注明版本号和日期,可刻录光盘)
6)研究者手册(IB)(注明版本号和日期)
7)研究病历(如有)(注明版本号和日期)
8)产品自检报告
9)产品注册检验报告
10)招募广告及招募方式说明(如有)(注明版本号和日期)
11)试验保险(如有)(提供保险凭证,如是外文凭证,需提供中文翻译版本,并提供两个版本一致性说明,公司盖章)
12)CRO的资质证明(如有)(营业执照,药品/器械生产许可证等)
13)申办方和CRO之间的委托书或合同(如有)
14)组长单位的批件、其他伦理委员会对本项目的否定性意见(如果有)
15)研究者简历(签名和日期,GCP证书复印件) ※
16)研究团队名单
17)数据安全监察计划(Data Safbty Monitor Plan, DSMP)(如有)(注明版本号、版本日期;如方案中有可不必单列)
18)风险控制计划(如有)(如方案中有可不必单列)
19)首次用于植入人体的医疗器械,该产品的动物试验报告(如有)
20)试验用医疗器械的研制符合适用的医疗器械质量管理体系相关要求的声明
21)临床试验合同
22)医疗器械临床试验机构临床试验申请表(已同意立项)
3. 简要版资料11份(订书钉装订,或燕尾夹夹好,轻便装订无需文件夹)
1) 封面(须含项目名称、目录)
2) 国家药品监督管理局《药物临床试验批件》或《临床试验通知书》或《备案信息文件》
3) 研究方案(中文版)
4) 知情同意书及提供给受试者的书面资料(如受试者须知、受试者日记、招募广告等)
二、修正案审查(复审与之相同)
1.完整版资料(1份,蓝色2孔文件夹按以下顺序整理,方案需盖申办者公章)
1) 修正案审查/复审审查申请表※
2) 修订说明,必须包含修改前描写,修改后描写,修改原因
3) 修订后资料(清洁版,需注明新的版本和日期)
4) 我院作为分中心参与的临床试验项目,须提交组长单位的伦理审查结论,我中心同意备案实施。
5) 递交我院伦理委员会的文件须与组长单位的文件保持一致。若因为中心专用版本等版本号不一致,须说明是否与组长单位伦理审查的原始版本一致;若与组长单位的原始版本一致,仅中心名字、版本日期等基本信息不一致,须由申办方出具相关说明,并盖章。
2.简要版资料11份(若修正案审查进行快审无需简要版),包括以下文件:
1) 更新的研究方案(含修订说明)
2) 更新知情同意书及提供给受试者的书面资料(含修订说明)(如有)
三、跟踪审查(包括:年度/定期研究进展报告、严重不良事件、方案偏离/违背、暂停/终止研究报告、结题报告)
1) 申请表※
四、伦理审查的费用
1) 试验项目初次审查:4000.00 元。
2) 试验项目修正案审查(若满足备案,无须交费): 1000.00 元。
五、伦理审查的时间
伦理委员会每个月例行召开审查会议2次,时间分别为每月第一周星期三、第三周星期三(如遇节假日则请咨询秘书开会时间)。
当月1日前上传系统的项目,当月第三周会审;当月15日前上传系统的项目,次月第一周上会。
研究过程中出现重大或严重问题,危及受试者安全时,或发生其它需要伦理委员会召开会议进行紧急审查和决定的情况,伦理委员会将召开紧急会议进行审查。
六、审查决定的传达
伦理委员会在做出伦理审查决定后5个工作日内,以“伦理审查意见”的书面方式传达审查决定。
七、联系方式
伦理委员会办公室电话/传真: 0816-2237206
联系人:唐喻莹、谭琴
Email:myszxyylcsyll@163.com
地址:四川省绵阳市涪城区常家巷12号
工作时间:周一至周五08:00-12:00,14:00-17:30